突然看到這樣一個題目難免有不知道它所指的是什麼的感覺,需要做一些說明。
我們都知道物質有三態:氣態、液態和固態。如果在一個系統中沒有別的東西,只有空氣或是只有水蒸氣,我們就可以說這個系統中只有一個氣相。如果在一個水壺中有液體的水也有水蒸氣,我們就可以說這個系統中有兩個相(phase)同時存在:氣相和液相。在一個水瓶中有一些冰塊漂浮在水中,我們就可以說這個系統中也是有兩個相同時存在:液相和固相。在一瓶水中加一些煤油,煤油漂在水面上,這時這個系統中有兩個液相。把這瓶加了煤油的水用力搖一段時間,讓煤油分散成為小油滴懸浮在水中,這時這個系統中仍然是有兩個液相,一個是油相,一個是水相。如果水中加的是酒精不是煤油,因為酒精和水可以相溶,所以混合之後仍然只有一個液相。在水中加鹽也是一樣,因為鹽會溶解在水中,所得的鹽水仍然是一個液相。如果鹽加得太多了,超過了其在水中的溶解度,一部分不能溶解到水中去,這系統中便有兩個相,鹽水是液相,沒有溶解的鹽是固相。一般的固體往往並不是均勻的,是由許多不同的結晶所構成的,因此,在一塊固體中可能存在有幾種不同的固相。
我們也都知道,物質的三態是可以相互轉變的,這種轉變就是所謂相的變化。常見的有以下幾種:
1.由液體變成蒸氣叫做蒸發(evaporation)或沸騰(boiling)。蒸發與沸騰雖然都是由液相轉變為其本身的氣相,但在基本的機制上有些不同,留待後面再詳細討論。
2.由蒸氣變成液體叫做凝結或冷凝(condensation)。
3.由液體變成固體叫做固化(solidification)。
4.由固體熔融成為液體叫做熔化或融化(melting)。
5.固體從溶液中析出叫結晶(crystallization)。
6.氣體從溶液中析出叫脫氣(degasing)。
………
其他相的變化還有很多,在這裡不必都一一例舉出來。由以上的說明看來,相的變化似乎是相當簡單的事,有什麼值得詳加討論的地方呢?因為萬事起頭最難,值得討論的地方在於相變化的開始。
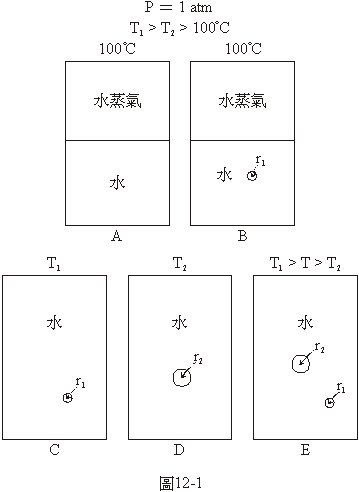
我們先用由液體的水沸騰而生成水蒸氣的相變化為例。大家都知道,水蒸氣與液體水平衡存在的溫度和壓力有一定的關係,壓力高時平衡的溫度也高,壓力低時平衡的溫度也低。在1大氣壓下水與水蒸氣平衡的溫度是100°C。在高山上氣壓比1大氣壓低,所以水不需要加熱到100°C就可以沸騰。在壓力比1大氣壓高的時候,平衡的溫度比100°C高,如果溫度仍然維持在100°C,水蒸氣就會凝結成為液體。 在圖12-1A的系統中的液體水與水蒸氣之間有一個水平的界面,換句話說,100°C的水是與1大氣壓的直徑為無限大的水蒸氣泡成平衡狀態。如果使壓力維持在1大氣壓,加一點熱到這個系統中,水就會蒸發一點,使水蒸氣增多一點;從這系統中拿走一點熱量,水蒸氣就會凝結一點,使水增多一點。
如果在溫度是100°C、壓力是1大氣壓與圖12-1A相同的系統中,在液體的水中出現了一個半徑為r1的水蒸氣的小泡,如圖

12-1B,這個小泡的下場會如何呢?因為水和水蒸氣之間的界面是有界面張力的,這個小泡就像一個有彈性的小氣球,氣球越小裡面的壓力越大。關於這一點,我們大概都有吹氣球的經驗,在最開始的時候最費力,就是因為氣球在半徑最小的時候使它膨脹所需要的壓力最大。圖12-1B中的小氣泡裡面,因為半徑很小所以壓力比外面大得多,外面是1大氣壓,氣泡裡面的壓力會比1大氣壓大得多。在這樣的情況下,這個小泡裡的水蒸氣一定會被壓縮而成為液體水,這個小泡難逃消失的命運。因為系統的溫度只有100°C,是與1大氣壓的水蒸氣平衡的溫度,對更高的蒸氣的壓力來說,100°C是一個過冷的溫度,會使泡中的水蒸氣凝結成液體而使這個小泡消失。
要在怎樣的情況下這個半徑為r1的水蒸氣的小泡才不會消失呢?就是要把系統的溫度提高,高到平衡的壓力與這個小水蒸氣泡裡的壓力相等的時候,它就不會消失了。在圖12-1C的系統中,是溫度為T1的水中有一個半徑為r1的水蒸氣的小泡。T1是一個比100°C高的溫度,與這個溫度平衡的壓力當然比1大氣壓要大,如果這因為溫度提高而增加的泡內水蒸氣的壓力正好足以與由於界面張力而產生的壓力相抗衡的話,這個水蒸氣的小泡就不會被壓縮而消失了。
圖12-1D是另一個平衡的系統,在這個系統中是溫度為T2的水中有一個半徑為r2的水蒸氣泡。因為r2比r1大,這個比較大的泡中由於界面張力而增加的壓力比圖12-1C中那個小泡中的要小,所以T2雖然要比100°C高,但不需要像圖12-1C中的T1那麼高,T2是介於100°C和T1之間的溫度。因為這個系統的溫度,T2,比100°C還是高一些,因此而增加的泡內水蒸氣的壓力就足以與由於界面張力而產生的壓力相抗衡了。
我們常說的水在1大氣壓之下的沸點是100°C,是指圖12-1A的系統而言,液體的水和水蒸氣之間有一個水平的半徑是無限大的界面。如果水蒸氣是一個泡,界面張力會使泡內產生一些額外的壓力,這時系統的溫度如果仍然維持在100°C,這額外的壓力便會把這水蒸氣的泡壓縮而使它消失。如果把系統的溫度提高,假如提高得不夠多的話,這泡仍然會被壓縮而消失,假如提高得剛好,使泡內水蒸氣的壓力足以與所受到的壓力相抗衡,這泡就會維持在平衡的狀態,假如溫度提高得過多,使泡內水蒸氣的壓力比所受到的壓力還大的話,這泡便會愈長愈大。
在圖12-1E的系統中,溫度介於T1和T2之間,水中有兩個半徑分別為r1和r2的水蒸氣的泡。T1和T2分別是使半徑為r1和r2的水蒸氣泡平衡存在的溫度。因此,這個系統的溫度,T,對半徑為r1的小泡來說是一個過冷的溫度,會使它由於泡內蒸氣的壓力不夠高,被壓縮而消失;對半徑為r2的大泡來說,系統的溫度,T,是一個過熱的溫度,會使泡內蒸氣的壓力比所受到的壓力更大而越長越大。因此,在圖12-1E的系統中,較小的泡會被壓縮而消失,較大的泡會越長越大。
水裡的水蒸氣的泡猶如一個氣球,氣球或氣泡裡面的水蒸氣的壓力要抗拒兩種力量,其一是水中原有的壓力,在上述的例子中是1大氣壓,其二是由於氣球的彈性或是水蒸氣和水之間的表面張力所產生的壓力。水蒸氣泡和氣球一樣,是半徑越小時由於表面張力所產生的壓力越大。要提高泡內水蒸氣壓力就得提高溫度,當溫度是100°C時,水蒸氣的壓力是1大氣壓,僅足以對抗泡外水中的壓力,不足以抗拒由於表面張力所造成的額外的壓力,因此,在這種情況下的水蒸氣的泡會被壓縮而消失。如果水的溫度雖然提高了,但尚未能高到使泡內水蒸氣的壓力與上述的兩種力量的和相等,這個泡仍然會被壓縮而消失,就如圖12-1E中的半徑為r1的小泡。如果水的溫度已經高到使泡內水蒸氣的壓力超過上述的兩種力量的和,這個水蒸氣泡就會越長越大,就如圖12-1E中半徑為r2的較大的泡,這時候就可以說這些水沸騰了。
圖12-2說明一個與圖12-1中的沸騰現象相反的問題。圖12-2A與圖12-1A相同,顯示在1大氣壓和100°C的溫度下液體
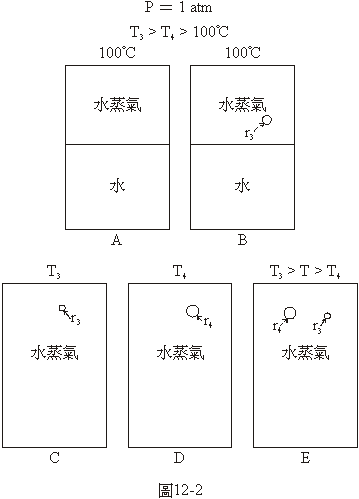
的水與水蒸氣平衡存在的狀況。這時如果在水蒸氣中有一個半徑為r3的小水滴,如圖12-2B,這個小滴的將如何呢?我們再把液體水和水蒸氣之間的界面想像成一層很薄的橡皮膜,橡皮膜有收縮的傾向,收縮的張力使內部的壓力比外部較大,而且半徑越小的球形的膜所造成的壓力越大,半徑越大的球形膜所造成的壓力越小,如果半徑大到無限大,像圖12-2A或圖12-2B中水平的界面那樣,就不會造成任何兩側間壓力的差異了。如果在一個球形橡皮膜的內側是溫度為100°C的水,外側是1大氣壓的水蒸氣,用針在這球形的橡皮膜上戳個小洞會怎麼樣呢?水當然會從這個小洞噴出來,因為橡皮膜外側水蒸氣的壓力是1大氣壓,內側水的壓力是1大氣壓再加上橡皮膜的收縮力所造成的額外壓力,裡面的壓力比外面大,水當然會從這個小洞噴出來。現在我們真正要討論的是懸浮在水蒸氣中的小水滴,它的表面張力有和橡皮膜一樣造成水滴內的壓力比滴外水蒸氣的壓力較大的作用,但沒有像橡皮膜那樣將水和水蒸氣隔離開的作用,滴中的液體分子會從表面的各處跑到滴外的水蒸氣中,這就是蒸發的現象。水滴的半徑越小、表面張力造成的壓力越大,蒸發的趨勢也越強。越蒸發越小、越小蒸發的趨勢越強,這樣一個懸浮在水蒸氣中的小水滴最後當然難逃消失的命運。
怎麼樣才能使這個小水滴不會因蒸發而消失呢?就是要使水滴內部的壓力與外側水蒸氣中的壓力相等。在圖12-2C的系統中,滴外水蒸氣的壓力如果仍然是1大氣壓的話,怎麼樣才能使滴內水的與系統溫度相當的壓力再加上表面張力所造成的壓力只等於1大氣壓呢?唯一的辦法就是降低系統的溫度。在圖12-2C的系統中的溫度是T3,如果這個半徑是r3的小水滴不會因為蒸發而消失,也不會越長越大的話,T3一定是一個與r3相當且比100°C低的溫度。在圖12-2D的系統中,壓力也是1大氣壓,水蒸氣中也有一個水滴,這個水滴的半徑是r4,比r3大,因為水滴比較大,由於表面張力而造成的壓力比較小,所以系統的溫度,T4,雖然要比100°C低,但不必降到像T3那麼低就可以使這個水滴不會因蒸發而消失,也不會越長越大。r4介於無限大與r3之間,T4也是介於100°C與T3之間的溫度。在圖12-2E的系統中,壓力也是1大氣壓,溫度是介於T3和T4之間,水蒸氣中有兩個水滴,一個半徑是r3,一個是r4。在這種情況之下這兩個水滴的命運會怎麼樣呢?因為系統的溫度比T3高,半徑為r3的滴內水的與系統溫度相當的壓力加上因為表面張力而造成的壓力要比1大氣壓大,這個較小的水滴會蒸發而消失;又因為系統的溫度比T4低,半徑為r4的滴內水的與系統溫度相當的壓力加上因為表面張力而造成的壓力要比1大氣壓還低,水蒸氣的分子會凝結在這個較大的水滴上而使它長大。這時候就可以說系統中的水蒸氣在冷凝或凝結了。
由前面的討論我們發現,在1大氣壓下,在清潔的純水中如果有一個水蒸氣泡,水的溫度要比100°C高,這個泡才有機會長大,泡的半徑越小所需要的溫度越高,如不夠高的話,這個泡就會被壓縮而消失。換句話說,在1大氣壓下,如果清潔的純水的溫度比100°C高,是T1,與T1這個溫度相當的有一個泡的半徑是r1,凡是半徑比r1小的泡都沒有機會長大,都會被壓縮而消失;凡是半徑比r1大的泡都會長大。這個半徑r1就是在1大氣壓之下溫度為T1的水中的蒸氣泡的「臨界半徑」。如果r1是溫度為T1時的臨界半徑,r2比r1大,是溫度為比T1較低的T2時的臨界半徑,若在溫度介於T2和T1之間的純水中有兩個水蒸氣的泡,一個的半徑是較小的r1,另一個的半徑是較大的r2,半徑為r1的小水蒸氣泡會被壓縮而消失,半徑為r2的較大的泡則會長大。
在1大氣壓下,在清潔的水蒸氣中如果有一個水滴,系統的溫度要比100°C低,這個水滴才有機會長大,水滴的半徑越小所需要的溫度越低,如果不夠低的話,這個水滴就會蒸發而消失。換句話說,在1大氣壓下,如果清潔的水蒸氣的溫度比100°C低,是T3,與T3這個溫度相當的有一個水滴的半徑是r3,凡是半徑比r3小的水滴都沒有機會長大,都會蒸發而消失;凡是半徑比r3大的水滴都會長大。這個半徑r3就是在1大氣壓下溫度為T3的水蒸氣中的水滴的「臨界半徑」。如果r3是溫度為T3時的臨界半徑,r4比r3大,是溫度比T3較高的T4時的臨界半徑,若在溫度介於T3和T4之間的清潔的水蒸氣中有兩個水滴,一個的半徑是較小的r3,另一個的半徑是較大的r4,半徑為r3的小水滴會蒸發而消失,半徑為r4的較大的水滴則會長大。
這是一件很有趣的現象:不論是水滴或是水蒸氣泡都是越大越容易長大,越小越不容易長大,而大的滴或泡都是由小的長大而成的,小的是從更小的長大而成的,…,最小的滴或泡的生存與長大最為困難。在人的社會和各種生物中也有許多類似的現象:幼小的生物,不論是動物或植物都是很脆弱的,長得越大越茁壯,競爭力也越強。經營一個企業也是創業維艱,小公司被大公司併吞掉也是常見的事。學術團體如果成員的人數太少也常因為小於「臨界規模」而難有好的成就。
因為大的水蒸氣的泡或水滴必須由小的長大而成,而小泡、小滴的誕生與成長又非常不易,所以在非常均勻清潔的系統中相的變化,不論是由水變成水蒸氣或是由水蒸氣變成水,都是極為困難的。在實際的系統中往往存在著一些「核」,或稱之為「種子」或「胚胎」,有了一些胚胎才有相變化開始的機會。大的水蒸氣泡、大的水滴、大的動物、植物、甚至大的企業都是由核或種子或胚胎開始成長而成的,這就是所謂「成核」的現象。舉例來說,當我們用一個水壺燒開水的時候,水壺的底往往都不是絕
對地光滑完美的,如果用放大鏡來觀察會發現壺底的表面實際上是凹凸不平的,其中難免有許多凹下的地方藏著一些小氣泡,這些小氣泡就是沸騰相變化的核。在1大氣壓下燒開水,當接近壺底的水的溫度超過了100°C,這些小氣泡的半徑到達了這個溫度下的臨界半徑時,它們就開始越長越大,沸騰就開始了。如果我們用一個很清潔光滑的玻璃燒杯來燒開水,因為杯底上的凹凸不平非常小,用放大鏡都看不出來,也許要用高倍的顯微鏡才能找得出一些來,因此要把杯中水的溫度燒得很高,這些不均勻的地方的核才到達臨界的大小,沸騰才會開始。也因為溫度已經比100°C高很多了,沸騰一旦開始就會變得非常劇烈,好像爆炸的樣子。大家大概都有開一瓶汽水或香檳酒的經驗,如果小心地把瓶蓋打開,不去振盪它,打開後並不會產生氣泡,這是因為瓶的內壁相當光滑,汽水或香檳中並沒有現成的種子或核。但是,如果在打開瓶蓋前先用力搖幾下,一開瓶蓋就會有很多泡沫噴出來。這當然是因為在搖的時候把瓶中的一點氣體分散成小氣泡,作為產生泡沫的核。在水蒸氣中水滴的生成也很類似,我們都知道在做人造雨的時候是用飛機在空中撒乾冰或碘化銀,都是在提供水滴開始成長的胚胎或種子或核。
上面提到的幾個相變化常見的實例,都是由於系統並非均勻完美而有一些外加的核或種子或胚胎,水蒸氣的泡或水的滴以這些核為起點開始長大而造成沸騰或冷凝的現象,這些相變化的起始叫做不均勻的成核(heterogeneous nucleation)。許多實際的相變化大多是由於不均勻的成核而開始的,因為我們生活的世界本來就不是很均勻的,空氣中總難免有一些霧滴或塵埃,水中也難免有些懸浮的小顆粒或氣泡。不均勻才是常態,均勻才是特例。
另一個常見的不均勻成核的例子是用甘蔗汁製糖時的結晶。把甘蔗汁從甘蔗中榨出來,經過清淨的程序後在真空中使其中一部分的水份蒸發,使糖份的濃度增加。當糖水的濃度超過飽和濃度不多的時候,因為其中沒有夠大的種子所以不會析出糖的結晶。這時便可以加入一些磨碎的糖粉,每一個糖粉的顆粒都是一粒種子或結晶的核,一旦加入到略為過飽和的糖水中後糖的結晶便開始在上面成長,成為一鍋大小相當一致的砂糖。
人體的血液中尿酸濃度過高的人會產生痛風的病症,所謂痛風就是在關節的液體中生成尿酸的結晶而導致的痛腫現象。但是有人體檢的報告中顯示血液中尿酸的濃度超過標準上限很多但沒有痛風的現象,有的人超過了一點就會痛,這也許就是因為前者的體液中沒有足夠大的種子或晶核而後者有的關係。
在系統絕對完美均勻的情況下怎樣才能使相的變化發生呢?如果液體的水中沒有懸浮的顆粒、氣泡或是任何的雜質,容器的壁也絕對地光滑,沸騰是否會開始呢?如果水蒸氣中沒有懸浮的霧滴、塵埃或是任何雜質,容器的壁也絕對地光滑,冷凝是否會開始呢?答案是會的,這時就是均勻的成核現象(homogeneous nucleation)。均勻成核所需要的過熱或過冷要比不均勻成核時大得很多,換句話說,就是在1大氣壓下,要使水開始沸騰,其溫度要比100°C高很多,要使水蒸氣凝結,其溫度要比100°C低很多。
先看在1大氣壓之下純水沸騰的問題。在100°C的水中,每個分子的能量並不是完全相同的,有的高有的低,應該是圖12-3中的曲線A那樣的常態分佈情況。在100°C的水蒸氣中,每個分子的能量也不是完全相同的,也是有的高有的低,其分佈的情形
應該像圖12-3中的曲線B那樣的常態分佈。在1大氣壓和100°C
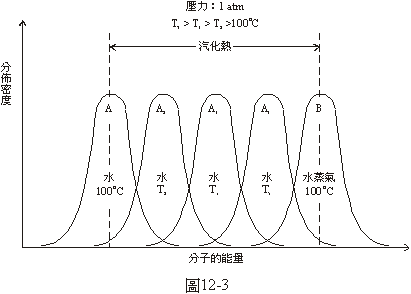
之下水分子的平均能量和水蒸氣分子的平均能量之間的差額就是水的汽化熱,也標示在圖12-3中。如果把水的溫度提高為T2,就是圖12-1D中的溫度,這時水中要是有一個比這圖中半徑為r2的蒸氣泡還略大一點的氣泡的話,它就會越長越大,沸騰就開始了。但是,由圖12-3中溫度為T2的水中分子能量的分佈曲線A2看來,根本沒有能量夠高到可以成為蒸氣的分子,也就不可能產生一個半徑比r2還大一點的水蒸氣泡。如果把水的溫度提高為T1,就是圖12-1C的溫度,這時水中要是有一個比這圖中半徑為r1的蒸氣泡還略大一點的氣泡的話,它就會越長越大,沸騰就開始了。但是由圖12-3中溫度為T1的水中分子能量的分佈曲線A1看來,其中雖然有少數能量很高的水分子,其能量與能量很低的100°C的水蒸氣分子相當,但是由於偶然的機會這些高能量的水分子碰到一起而形成一個半徑比r1還大些的泡的可能性還是非常小,沸騰開始的機會也極小。如果把水的溫度提高為比T1更高的T5,這時水中要是有一個與T5相當的半徑為r5的水蒸氣泡的話,它就會越長越大,沸騰就開始了。因為T5比T1高所以r5比r1小,出現這樣一個泡的機會當然比較大。再由圖12-3中溫度為T5的水分子能量的分佈曲線A5看來,其涵蓋的面積與代表100°C的水蒸氣分子能量分佈的曲線所涵蓋的面積有相當大的重疊部分。換句話說,溫度為T5的水中有許多分子的能量高得夠資格當水蒸氣,這些能量高的水分子由於偶然的機會正好碰到一起而形成一個半徑是r5的小泡的可能性也很大,這樣一個小蒸氣泡一旦形成了,它就會越長越大,沸騰就開始了。因此,欲使絕對純淨的液體經由均勻成核而沸騰需要將其加熱到比平衡溫度(上面例子中的100°C)高出很多的溫度。
如果欲使絕對純淨的蒸氣經由均勻成核而冷凝成為液體,與沸騰的情況非常相似,就是需要將其冷卻到比平衡溫度低很多的溫度。以1大氣壓下水蒸氣的冷凝為例,圖12-4中曲線A和B和圖12-3中一樣分別是100°C下水和水蒸氣中分子能量的分佈情形,假定大致上都是常態的分佈。100°C的水分子的平均能量與100°C的水蒸氣分子的平均能量之間的距離就相當於水的汽化熱。曲線B4、B3和B6分別是溫度為T4、T3和T6的水蒸氣中分子能量分佈的情形。T4比100°C低,就是圖12-2D中的溫度,T3比T4更低,就是圖12-2C中的溫度,T6比T3更低,是一個很低的溫度。在溫度為T4的水蒸氣中如果有一個半徑比圖12-2D中的r4略大的水滴,它就會越長越大而使冷凝開始,但由圖12-4中曲線B4所顯示的能量分佈情形看來,在溫度為T4的水蒸氣中根本沒有能量低到可以當液體的分子,當然也就不可能產生一個半徑比r4還大些的水滴,冷凝也不可能開始。在溫度為T3的水蒸氣中如果有一個半徑比圖12-2C中的r3略大的水滴,它就會越長越大而使冷凝開始,但由圖12-4中曲線B3所顯示的能量分佈情形看來,
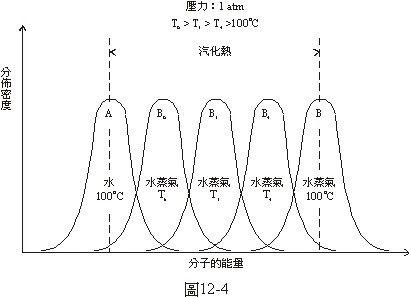
在溫度為T3的水蒸氣中,雖然有少數能量很低的分子,它們的能量與100°C的水中能量很高的分子相當,但是由於偶然的機會,這些能量很低的水蒸氣分子正好碰到一起而形成一個半徑比r3還大些的水滴的可能性還是非常小,冷凝開始的機會也極小。如果把水蒸氣的溫度降低為比T3更低的T6,這時水蒸氣中要是有一個與T6相當的半徑為r6的水滴的話,它就會越長越大,冷凝就開始了。因為T6比T3低所以r6比r3更小,出現這樣一個水滴的機會當然比較大些。再由圖12-4中溫度為T6的水蒸氣分子能量分佈的曲線B6看來,其涵蓋的面積與代表100°C的水分子能量分佈的曲線A所涵蓋的面積有相當大的重疊部分。這表示在溫度為T6的水蒸氣中有許多分子的能量低得可以當液體,這些能量夠低的水蒸氣分子由於偶然的機會正好碰在一起而形成一個半徑是r6的小水滴的可能性也很大,這樣一個小水滴一旦形成了,它就會越長越大,冷凝就開始了。
成核與相的變化是物理現象,它的原則也可以用到許多化學現象、生物現象、甚至人的社會現象中去。舉一個例來說,在歷史上的每一個朝代中都會有一些想「造反」的人。什麼樣的人想造反呢?吃不飽而看到當權者又有「朱門酒肉臭」現象的人想造反。社會上的貧窮和貧富不均就好像造成沸騰的「過熱」、造成冷凝的「過冷」或是造成結晶的「過飽和」。要使造反成功,造反的叛黨需要有一個臨界的規模。當社會愈貧窮的時候,這個必要的臨界規模愈小,只要少數人登高一呼,各地的飢民都會揭竿而起四處響應。當社會愈貧窮的時候形成一個臨界規模的叛黨也愈容易,因為想要鋌而走險的人四處皆是。當社會上貧富差距不太大,窮人也不是真的很窮的時候,要成立一個叛黨是很難的,因為大家日子過得好好的,願意冒險的人很少,使造反成功的叛黨的必要臨界規模也很大,因為大家都怕有風險,一定要等到叛黨的一邊可能是大邊的時候才會有較多的西瓜靠過來。外來的勢力所造成的改朝換代相當於由不均勻成核所引發的相變化。核雖然是外來的,但系統的本身也要有足夠的過熱、過冷或過飽和才可能使相變化發生。北宋若非積弱腐化,許多好漢也不會上梁山,也不會被女真人取代;明末若非飢餓貧窮,老百姓也不會唱著鳳陽花鼓追隨李自成,也不會被滿清所取代;在滿清的全盛時期,老百姓過得不錯的時候,若有人想驅逐韃虜,成功的機會也不會很高的。